Une nouvelle molécule pour cibler et éliminer les cellules cancéreuses grâce à la lumière
Utilisées principalement dans le traitement de certains cancers, les thérapies photodynamiques sont des traitements peu invasifs. Elles reposent sur l’utilisation de photosensibilisateurs, des molécules capables de s’exciter au contact de la lumière et de transmettre leur énergie au dioxygène contenu dans les cellules ciblées, le rendant toxique et provoquant la mort de ces dernières.
À travers une collaboration interdisciplinaire et internationale, des scientifiques du Laboratoire de chimie (CNRS/ENS de Lyon), du Building Blocks for Future Electronics Laboratory (CNRS/Sorbonne Université/Yonsei University) en Corée du Sud, du laboratoire Moltech-Anjou (CNRS/Université d’Angers) et leurs collègues sud coréens ont conçu un nouveau photosensibilisateur, appelé DBI. Cette molécule s’est révélée beaucoup plus efficace que les photosensibilisateurs employés dans les traitements actuels, permettant d’envisager une utilisation à des doses thérapeutiques 10 à 100 fois plus faibles. L’emploi du DBI pourrait ainsi minimiser les possibles effets indésirables sur les tissus sains. Cette efficacité a été caractérisée et testée in vitro sur des cellules humaines et in vivo sur des embryons de poissons zèbres par leurs collègues suédois.
Le DBI a été élaboré à partir d’un colorant initialement utilisé par l’industrie textile et produit annuellement à l’échelle de plusieurs tonnes. En modifiant chimiquement sa structure, les scientifiques lui ont conféré de nouvelles propriétés photosensibilisatrices. Par ailleurs, le DBI a également acquis, de par sa structure, la capacité d’interagir avec l’ADN contenu dans les exosomes, des composants surexprimés dans les cellules cancéreuses. Le photosensibilisateur s’accumule ainsi préférentiellement dans ces compartiments cellulaires clés des cellules cancéreuses, où le stress oxydatif généré par exposition à la lumière conduit à la dégradation de l’ADN et in fine à la mort de la cellule.
Des études complémentaires sont en cours afin de déterminer si cette molécule pourra faire l’objet d’une utilisation clinique.
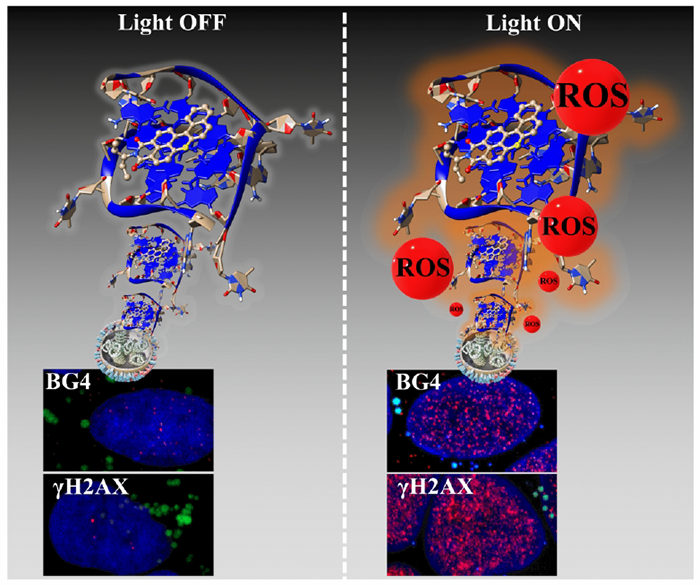
Au-dessus de ces images microscopiques figure une modélisation des complexes formés entre des séquences spécifiques ADN (télomères) et le photosensibilisateur.
© Sabouri et al. / Nucleic Acids Research